发表期刊:Environ Res.
发表年份:2023年
影响因子:8.43
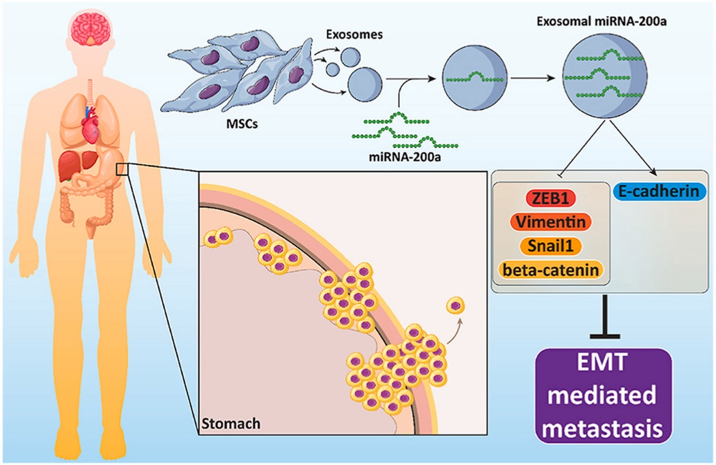
Exosome-mediated miR-200a delivery into TGF-β-treated AGS cells abolished epithelial-mesenchymal transition with normalization of ZEB1, vimentin and Snail1 expression
外泌体介导的miR-200a递送到TGF-β处理的AGS细胞中,通过使ZEB1、vimentin和Snail1表达正常化,可消除上皮-间质转化
胃癌(GC)是导致患者死亡的主要原因之一,这种恶性疾病影响胃肠道,其侵袭性和异常迁移导致患者预后不良。转移是胃癌的一个越来越大的挑战,microRNAs (miRNAs)是转移和相关分子途径特别是上皮-间质转化(EMT)的潜在调节剂。本研究目的是探索外泌体递送miR-200a递送抑制EMT介导的GC转移中的作用。通过分子尺寸排阻色谱SEC从MSCs中分离外泌体,后通过电穿孔负载miR-200a mimics。AGS细胞系暴露于TGF-β进行EMT诱导,然后将这些细胞与负载miR -200a的外泌体共培养。外泌体中小核酸的装载效率是5.92 ± 4.6%。外泌体诱导AGS细胞中miR-200a表达上调14.89倍。在机制上,miR-200a提高E-cadherin水平,降低β-catenin、vimentin、ZEB1和Snail1的表达,导致GC细胞EMT抑制。该临床前研究介绍了一种新的miR-200a递送策略,该策略对于防止GC细胞的迁移和侵袭具有重要意义。
发表期刊:J Extracell Vesicles.
发表年份:2022年
影响因子:17.34
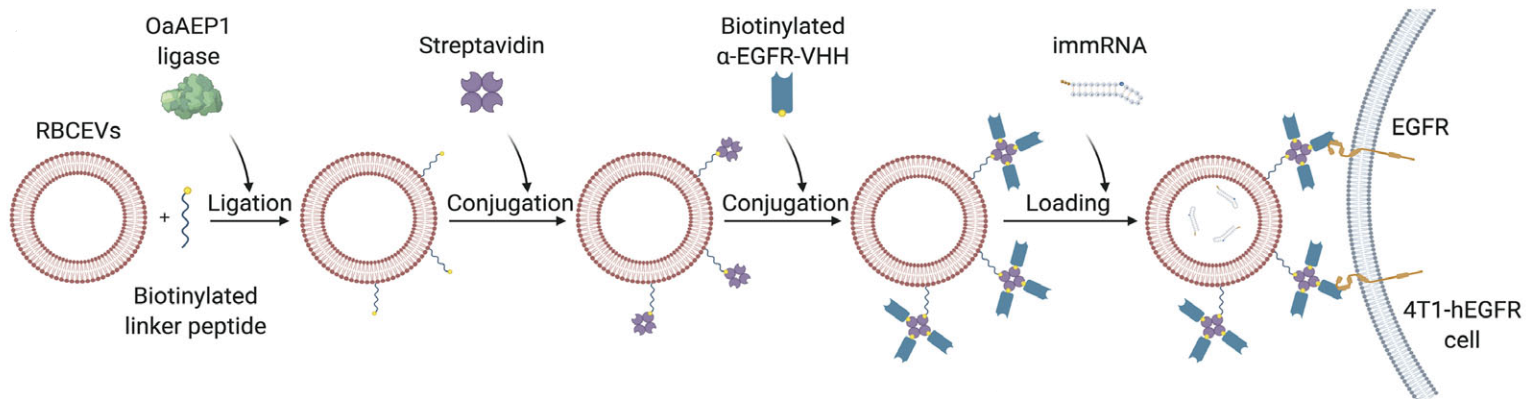
Robust delivery of RIG-I agonists using extracellular vesicles for anti-cancer immunotherapy
细胞外囊泡递送RIG-I激动剂用于癌症免疫治疗
RIG-I通路可被含有5'三磷酸的RNA激活,导致I型干扰素释放和免疫激活。因此RGI- 1激动剂作为潜在的免疫疗法已被用于诱导针对癌症的免疫反应。然而,体内将5'三磷酸化RNA分子作为RIG-I激动剂递送到肿瘤细胞是具有挑战性的,因为这些分子容易降解。本研究展示了红细胞来源的细胞外囊泡(RBCEV)用于RIG-I激动剂的递送。首先作者评估了两种新型RIG-I激动剂的抗癌活性,一种是具有独特二级结构的免疫调节RNA (immRNA),可以有效激活RIG-I;另一种是具有RIG-I激活和miR-125b抑制双重功能的5'三磷酸化反义寡核苷酸(3p-125b-ASO)。RBCEV递送的immRNA和3p-125b-ASO可触发RIG-I通路,诱导小鼠和人乳腺癌细胞死亡。此外观察到,在多次瘤内注射装载immRNA或3p-125b-ASO的外泌体后,肿瘤生长受到显著抑制,同时免疫细胞浸润增加,这是由RIG-I级联激活介导的。通过肺内给药,将外泌体与EGFR靶向的纳米体靶向递送immRNA,促进了外泌体在转移性癌细胞中的积累,导致有效的肿瘤特异性CD8+ T细胞免疫反应。这有助于显著抑制乳腺癌在肺部的转移。利用外泌体有效递送RIG-1激动剂的新策略,用于癌症和癌症转移的免疫治疗。
发表期刊:Biomaterials.
发表年份:2021年
影响因子:15.3
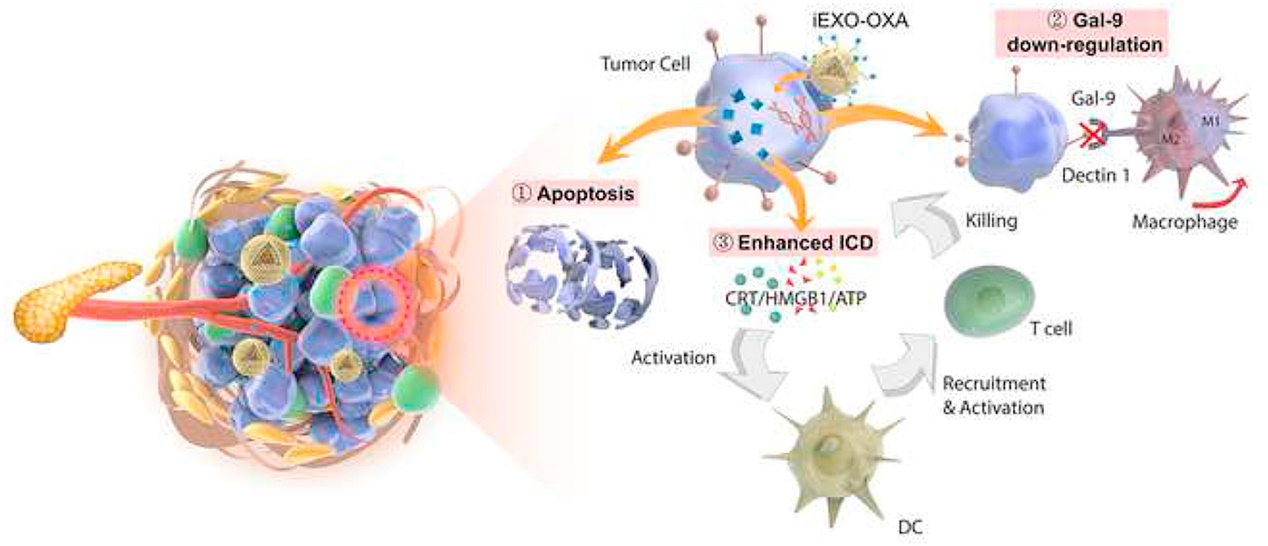
Pancreatic cancer-targeting exosomes for enhancing immunotherapy and reprogramming tumor microenvironment
胰腺癌靶向的外泌体增强肿瘤免疫治疗和肿瘤微环境重编程
由于化疗等常规治疗方法不能有效改善胰腺导管腺癌PDAC患者的总体生存结果,免疫治疗在治疗PDAC方面越来越受到关注。然而,由于PDAC独特的肿瘤微环境和较低的肿瘤免疫原性,使得PDAC的免疫治疗面临困境,诱导更多的肿瘤内效应免疫细胞以及逆转免疫抑制是PDAC治疗的核心。本研究作者构建了一种外泌体双载递送系统,干细胞外泌体电穿孔负载galectin-9 siRNA,并在表面修饰了奥沙利铂OXA药物前体用于免疫细胞死亡(ICD)触发剂。这种双载系统可增强PDAC免疫治疗,并在半乳糖凝集素-9/检测素1轴破坏后逆转M2样肿瘤相关巨噬细胞(M2-TAMs)的肿瘤免疫抑制。可显著提高肿瘤靶向疗效,从而增加药物在肿瘤部位的蓄积。这种基于外泌体的联合治疗通过抑瘤性巨噬细胞极化、细胞毒性T淋巴细胞募集、Tregs下调等机制引发抗肿瘤免疫,在肿瘤治疗中取得显著疗效。
发表期刊:Theranostics.
发表年份:2021年
影响因子:11.6
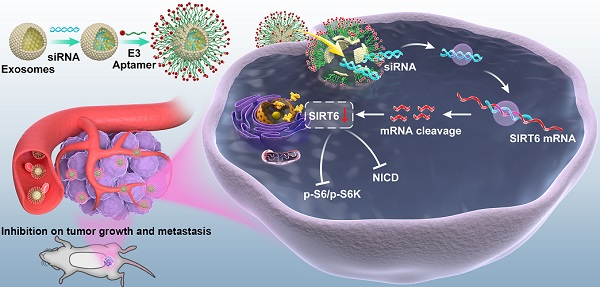
Targeted inhibition of SIRT6 via engineered exosomes impairs tumorigenesis and metastasis in prostate cancer
通过工程外泌体靶向抑制SIRT6进而阻碍了前列腺癌的发生和转移
转移性去势抵抗性前列腺癌患者的治疗在临床上仍然是一个巨大的挑战,不断需要发现新的靶点和治疗方法。本研究作者评估了SIRT6在转移性去势抵抗性前列腺癌中的功能和治疗价值。作者在HEK293外泌体中通过电穿孔负载siRNA,然后通过胆固醇脂锚连接靶向肽,获得靶向前列腺癌病灶区域的外泌体。结果显示SIRT6表达与前列腺癌进展呈正相关。SIRT6的缺失在体外和体内均能显著抑制前列腺癌细胞的增殖和转移。通过工程外泌体递送siRNA可沉默SIRT6进而抑制了肿瘤生长和转移,通过工程外泌体抑制SIRT6可以作为一种有前景的临床治疗方案。