发表期刊:Nat Biomed Eng.
发表年份:2023年
影响因子:29.31
Intradermally delivered mRNA-encapsulating extracellular vesicles for collagen-replacement therapy
胞外囊泡递送胶原蛋白mRNA用于老化皮肤的修复
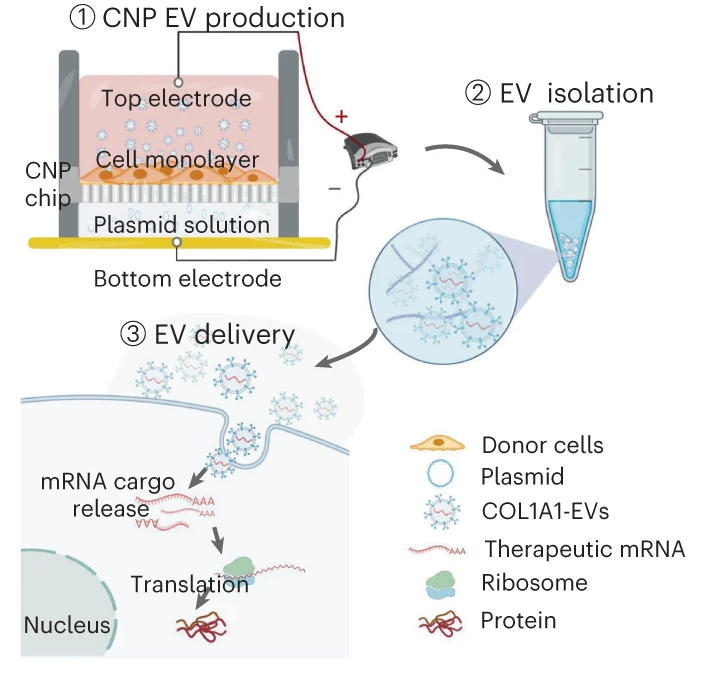
mRNA疗法的成功在很大程度上取决于递送系统的可及性,该系统需能够安全、有效和稳定地将遗传物质转化为功能性蛋白质。作者发现,人真皮成纤维细胞来源的细胞外囊泡(EVs),包裹上编码细胞外基质α1型胶原(COL1A1)的mRNA,可诱导胶原蛋白的形成,并减少光老化小鼠皮肤中由于胶原蛋白缺失所引起真皮组织中的皱纹形成。研究还表明,通过微针将装载mRNA的EV递送到真皮后导致动物真皮中胶原蛋白长时间且均匀的合成和替代。通过EV真皮递送COL1A1 mRNA可能成为治疗光老化皮肤的有效蛋白替代疗法。
发表期刊:Adv Mater.
发表年份:2022年
影响因子:32.09
Rapid Surface Display of mRNA Antigens by Bacteria-Derived Outer Membrane Vesicles for a Personalized Tumor Vaccine
通过细菌来源的外膜囊泡表面显示mRNA抗原用于个体化肿瘤疫苗
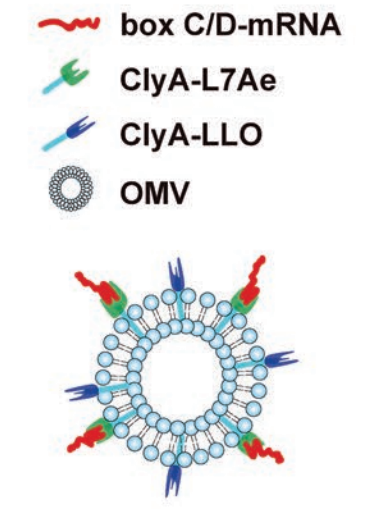
治疗性mRNA疫苗接种是触发抗肿瘤免疫的一种有吸引力的方法。然而,定制肿瘤疫苗的mRNA递送技术仍然十分有限。在这项工作中,细菌来源的外膜囊泡(omv)通过基因工程作为mRNA传递平台,RNA结合蛋白L7Ae通过与溶酶体逃逸蛋白listeriolysin O 融合到OMV外表面(OMV-LL)。OMV-LL可以通过L7Ae结合mRNA的C/D box序列实现mRNA抗原的装载(OMV-LL-mRNA),并将其递送到树突状细胞(DC)中,随后通过listeriolysin O介导的内涵体逃逸进行交叉呈递。在结肠癌模型中,OMV-LL-mRNA显著抑制黑色素瘤的进展,并导致37.5%肿瘤完全消退。OMV-LL-mRNA诱导小鼠长期免疫记忆,并在60天后保护小鼠免受肿瘤侵袭。总之,该平台提供了一种不同于脂质纳米颗粒(LNPs)的递送技术,用于个性化mRNA肿瘤疫苗接种,并且是一种“Plug-and-Display”的方式,使其能够在mRNA疫苗中广泛应用。
发表期刊:Matter.
发表年份:2022年
影响因子:19.97
Inhalable dry powder mRNA vaccine based on extracellular vesicles
可吸入的外泌体冻干粉mRNA疫苗
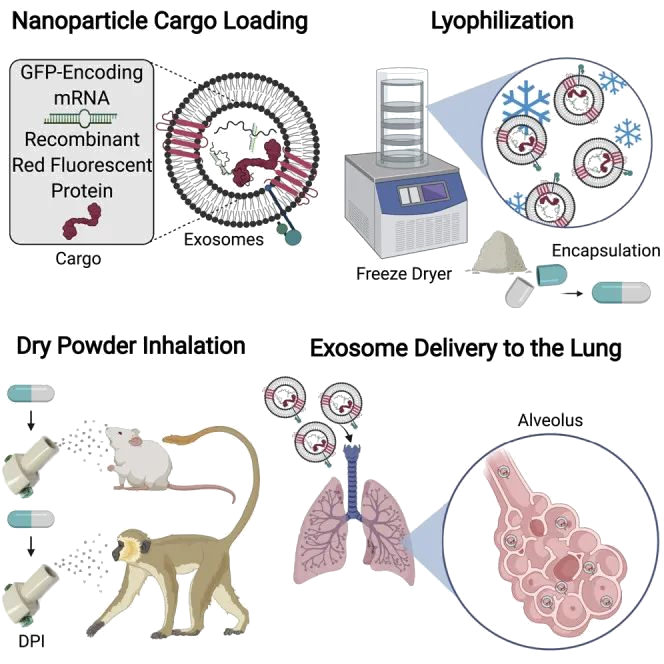
呼吸系统疾病是一个全球性负担,数百万人死于肺部疾病和功能障碍。虽然已开发了治疗方法,但它们在肺生物利用度和产品稳定性方面存在局限。为了规避这些限制,作者开发了室温稳定的可吸入的肺源性细胞外囊泡或外泌体(Lung-Exos)作为mRNA和蛋白质药物载体。与标准合成纳米颗粒脂质体(Lipos)相比,Lung-Exos具有更好的细支气管和实质分布,并且可以通过干粉吸入到啮齿类动物和非人灵长类动物(NHPs)的肺部。在疫苗应用中,严重急性呼吸道冠状病毒2 (SARS-CoV-2)刺突(S)蛋白编码mRNA负载的外泌体(S- exos)比负载mRNA的脂质体(S- lipo)引起更大的免疫球蛋白G (IgG)和分泌IgA (SIgA)反应。重要的是,S-Exos在室温下保存了一个月仍具有活性。该研究结果表明,细胞外囊泡可以作为优于合成脂质体的一种吸入式的mRNA药物递送系统。
发表期刊:Nat Commun.
发表年份:2021年
影响因子:17.69
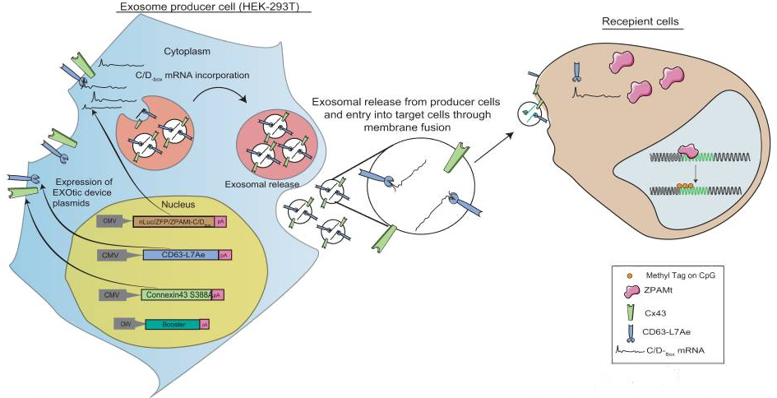
Exosome-mediated stable epigenetic repression of HIV-1
外泌体介导对HIV-1的稳定表观遗传抑制
人类免疫缺陷病毒(HIV-1)可产生持续潜伏感染。使用联合抗逆转录病毒疗法(cART)控制HIV-1的代价是副作用和产生耐药性。一种理想的、更安全的治疗方法应该能够在体内进行,并能实现稳定的表观遗传抑制,诱导病毒表达的稳定“阻断和锁定”。为此,作者开发了一种靶向HIV-1启动子的锌指蛋白(ZFP-362),融合到DNA甲基转移酶3a的活性区域,诱导HIV-1的长期稳定的表观遗传抑制。细胞被工程化改造以产生包裹有编码这种HIV-1抑制蛋白的RNA的外泌体。在人源化NSG小鼠模型中,作者发现负载了抗HIV-1抑制因子的外泌体可抑制病毒表达,这种抑制机制是由HIV-1 DNA甲基化驱动的。本研究结果为外泌体递送药物治疗表观遗传抑制HIV-1感染铺平了道路。
发表期刊:Theranostics.
发表年份:2021年
影响因子:11.6
Exosome-mediated delivery of inflammation-responsive Il-10 mRNA for controlled atherosclerosis treatment
外泌体递送IL-10 mRNA用于动脉粥样硬化治疗
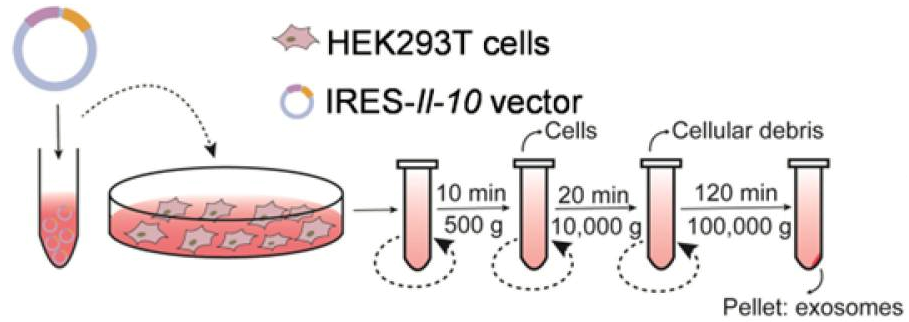
理论依据:在动脉粥样硬化等炎症性疾病的治疗中,有针对性地控制炎症是非常必要的。IL-10是一种有效的抗炎细胞因子,但由于免疫抑制,全身性反复给药可能导致有害的副作用。在这项研究中,作者开发了一种纳米系统,可以将炎症反应性IL-10 mRNA优先递送到巨噬细胞中,以进行量身定制的炎症控制。
方法:IL-10被设计成含有修饰的HCV-IRES(丙型肝炎病毒内核糖体进入位点),其中两个miR-122识别位点被两个miR-155识别位点取代。通过Western blot或ELISA检测工程化mRNA对miR-155的翻译反应性。此外,通过在供体细胞中强制表达,工程IL-10 mRNA被动包裹到外泌体中。在ApoE-/-(载脂蛋白E缺乏)小鼠中分析了功能化外泌体对动脉粥样硬化的治疗作用和系统暴露的影响。
结果:当外源表达miR-155或内源性miR-155诱导的M1极化巨噬细胞中,工程IRES-IL-10 mRNA可以在细胞中被翻译激活。此外,工程IRES-IL-10 mRNA被包裹在外泌体中后,可以有效地递送到ApoE-/-小鼠斑块中的巨噬细胞和其他细胞类型中。在斑块受体细胞中,外泌体递送的IL-10 mRNA被翻译成功能性蛋白,而在其他组织/器官中暴露较少,无明显炎症反应。